微创介入治疗学科是介于“内外科之间”的新兴学科,由于快速发展,业已和“外科、内科一道”被称为“三大支柱性”学科。各大医疗机构相继开设微创介入治疗学科,通常被理解为:是“医院学科建设”的需要,是医院“进步、发展”的需要。
凡是通过“影像设备”引导,如:通过透视/血管造影、CT/MRI、PET-CT/PET-MRI、超声影像等引导,或者通过内镜引导,将“微创介入治疗器具”,如:导管、微导管、微小微创消融针具等器具,直接插入人体内,直接对“肿瘤病灶”实施“物理性、化学性、生物性治疗”等,“统称为”肿瘤的微创介入治疗。现将我科室“优势突出、疗效显著、体现微创现代医学理念”的部分特色治疗技术简要介绍如下。
一.射频消融治疗
1.机理:射频发生器发出的高频射频电流,通过插入肿瘤病灶远端(近0-1cm)的消融针具(电极针、多极电极针),导入肿瘤组织。交流电场的快速变化,激发肿瘤组织内正负离子快速震荡,产生分子水平的摩擦,变电能为热能。消融病区的局部温度高达90—120℃,肿瘤组织凝固性坏死、变性;同时,在肿瘤病灶周边区域形成一圈隔离层,减少癌细胞血供,阻止癌细胞转移。射频消融治疗系统为闭合系统,需要在体外加用回路阴性电极板形成闭合回路。阳性电极电流为集中射频电流,阴性电极电流为分散回收射频电流。阳性电极区域为热效应区域。医用射频输出功率的设定范围 5-150W,频谱为200—750KHz,其中,MEDSPHERE公司射频的频率为480KHz、RITA公司射频的频率为460KHz。
2.现代射频消融治疗设备的特点:
(1)拥有“多点实时测温”装置。确保:消融靶区的温度90—120℃,获得根治性消融。肿瘤靶区指肿瘤以及超过肿瘤边缘0.5cm以上的癌旁组织。
(2)拥有“专利的锚型”设计。能够固定肿瘤病灶,防止“消融治疗全过程”脱靶。
(3)消融针具的电极子针可以“任意调节”长短,“分布”呈“圣诞树状”、“伞状”。1)消融靶区呈球形,符合绝大多数肿瘤病灶的外观,适形性更好的同时,邻近重要脏器的损伤在“可控制”的范围内。2)既往消融针具为单针电极,消融靶区呈锥形、椭圆形,癌残留的几率较高。
(4)拥有消融针具的“注水孔”设计。1)注水能够减少碳化、降低抗阻,2)有利于:“热量”传导、增大“输出”功率、扩大消融范围,尤其对含有空气的组织更有利(如肺组织) ;3)注水孔还可以注入麻醉药、无水酒精、化疗药物等,有减症、治疗和增效等作用。
(5)拥有“自动切断”装置。当阻抗增高,“超限”高于500Ω时,射频发生器停止发出高频射频电流,确保医疗安全。
(6)拥有双控模式 (即温度控制模式和功率控制模式)
功控模式-瓦控模式:是最常用模式。1)仅仅设定输出功率,不设定消融治疗温度。2)随着输出功率的增大,消融治疗温度随之逐渐增高。3)通常设定:初始输出功率90-100W、消融治疗时间5-10M。其优势显著:同时显示:输出功率、消融治疗温度、消融治疗时间、抗阻;消融治疗时间短暂、操作过程快捷(对于直径3cm以内的单发肿瘤病灶,消融治疗时间通常只需0.5-2分钟);可以及时调整输出功率,确保消融治疗温度。
温控模式:也是常用模式。1)设定消融治疗温度高于/等于95 ℃。消融治疗全过程,恒定不变。2)温控模式的消融范围较瓦控模式略为扩大,但消融治疗时间显著延长。3)通常设定:初始输出功率100-120W、消融治疗时间10-20M。
(7)能够进行“针道”消融,降低针道的肿瘤种植转移率。大宗数据的文献报道:无针道消融,针道的肿瘤种植转移率大约占4%。
射频消融治疗模拟及示意图
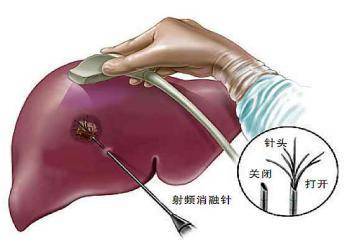
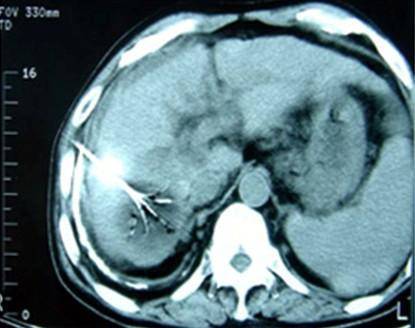
上图为超声影像引导的射频消融治疗模拟图,下图为CT影像引导的射频消融治疗示意图:下图中,肝脏8、7段低密度区域为肿瘤病灶;白色针状物为消融针具(电极针),电极针前端呈伞状分布的为电极子针(多极电极针或者多弹头)。
射频消融治疗疗效模拟图
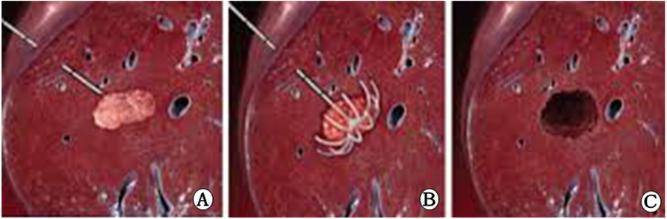
A图中,粉红色区域为肿瘤病灶;白色针状物为消融针具(电极针)。B图中,电极针前端呈圣诞树状分布的为电极子针(多极电极针)。C图中,空洞为消融治疗后,“肿瘤以及超过肿瘤边缘0.5cm以上的癌旁组织完全坏死后”形成,获得根治性消融。
二. 微波消融治疗
1.机理:微波发生器发出的微波,实际上,是频率分别为915MHz和2450MHz的两种高频电磁波。通过插入肿瘤病灶远端的消融针具(单针电极),导入肿瘤组织。肿瘤组织吸收大量微波能后,激发肿瘤组织内水、蛋白质等极性生物大分子频繁改变极化方向,产生分子水平的摩擦,变微波能为热能。消融靶区的局部温度即刻高达65—100℃,肿瘤组织即刻凝固性坏死、变性。当温度超过100℃时,出现碳化、气化。
2. 现代微波消融治疗特点:
(1)频率高,频率分别为915MHz和2450MHz。
(2)产热快,消融靶区的局部温度即刻高达65—100℃。
(3)热量高,热沉效应小,疗效显著。
(4)热量传导快。1)消融靶区“近段和远端”几乎同时加热,几乎不受阻抗的影响。2)随着消融治疗时间的延长,消融范围随之逐渐扩大。
(5)消融靶区的边界清晰、圆滑,但消融靶区呈锥形。
(6)微波消融治疗系统为开放系统,消融针具为单针电极,无需在体外加用“回路阴性电极板”形成闭合回路,无“回路阴性电极板”所导致的烧伤。
(7)正因为微波消融治疗系统具有“频率高、热量高、产热快、热量传导快、消融治疗时间短暂,操作过程快捷”等特点,也适用于开放性手术的补充治疗。
微波消融治疗模拟图
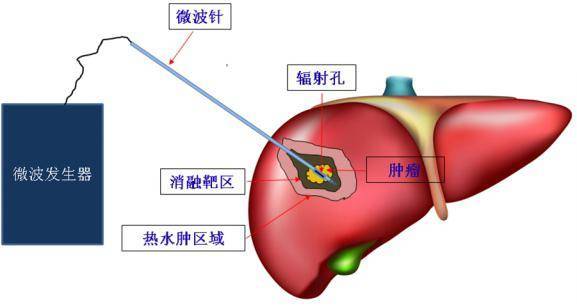
图中,黄色区域为肿瘤病灶。浅蓝色针状物为消融针具(单针电极)。深咖啡色区域为消融靶区,“消融靶区的温度”足以使“肿瘤以及超过肿瘤边缘0.5cm以上的癌旁组织”完全坏死,获得根治性消融。粉红色区域为热水肿区域,温度较低,不能获得根治性消融。
微波消融治疗疗效示意图
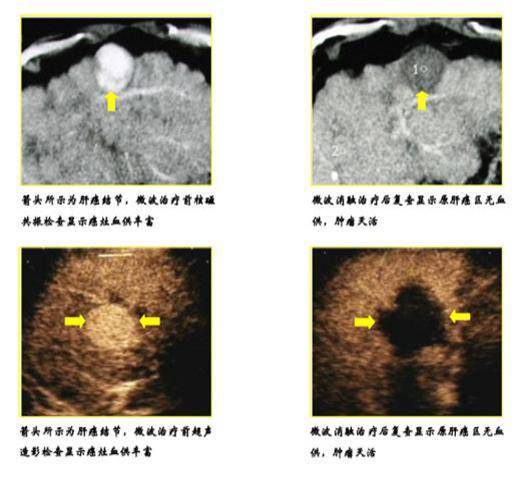
左上图:消融治疗前,磁共振检查:高信号区域为肿瘤病灶,血供丰富;右上图:消融治疗后,低信号区域为肿瘤病灶及其周边区域,无血供、灭活。左下图:消融治疗前,超声造影检查:高回声区域为肿瘤病灶,血供丰富;右下图:消融治疗后,无回声暗区为肿瘤病灶及其周边区域,无血供、灭活。
三. 氩氦刀消融治疗
1.机理:氩氦刀“输出管道”输出的“高压气体”,通过插入肿瘤病灶远端—刀尖上的“小孔”(焦耳—汤普森小孔),释放到“刀尖及其周边区域”较大的空间。由于高压气体压力的“急剧下降”,“刀尖及其周边区域”的温度随之“急剧下降或者上升”,这种效应称为Joule-Thomson效应 ,也称为气体的“节流效应”。数十秒内,氩气可使“刀尖及其周边区域”的温度 “下降”到零下175 ℃以下,氦气可使刀尖及其周边区域的温度“上升”到零上45 ℃以上。
2.具体机制:
(1)细胞内、细胞外,“急剧的结冰——融化”过程,冰晶可直接切割细胞膜和细胞器,损伤细胞结构,导致细胞坏死。(2)细胞内、细胞外,“渗透压”的“急剧变化”,细胞发生“皱缩和膨胀”,导致细胞坏死。(3)小血管内“冰晶”形成,“冰晶”可栓塞血管,导致细胞“缺血性”坏死。(4)坏死组织可“激发”机体的免疫反应。
3.冷冻消融治疗的主要优势:(1)患者对冷冻消融治疗的“耐受力”高于热消融治疗,痛苦相对较小。(2)消融靶区的成像边界即为治疗边界,边界清晰、无伪影,达到所见即所得的最佳医疗效果(what you see is what you get),邻近重要脏器的损伤在“可控制”的范围内。(3)消融治疗全过程,无碳化、气化 ,有利于冷量传导和实时监测。(4)特有的“冷冻消融治疗免疫反应”高于热消融治疗。
氩氦刀消融靶区CT示意图
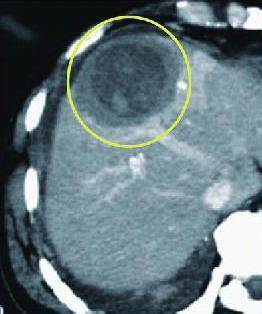
图中,消融靶区包括内圈、外圈。内圈(深色低密度区域)为肿瘤病灶,外圈(深色偏浅低密度区域)为治疗边界。消融靶区,成像清晰。
氩氦刀消融治疗疗效CT示意图
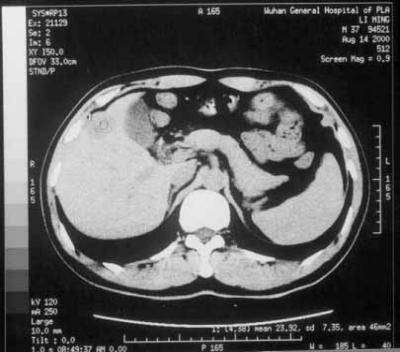
上图,消融治疗前,肝脏第Ⅴ段低密度区域为肿瘤病灶
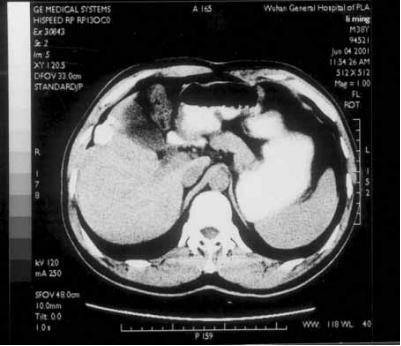
下图,消融治疗一年后复查,肿瘤病灶消失
医学界业已达成“共识”:除“根治性手术切除”以外, “有根治性微创消融治疗适应症”的肿瘤患者,通过微创消融治疗,也能够“治愈”。射频、微波、氩氦刀“这三大微创消融治疗手段”是“除根治性手术切除”以外,能够“治愈”肿瘤患者的“最佳治疗手段”之一。
四.放射影像引导 “经动脉血管”的介入治疗
1.包括“两个阶段”:数字减影动脉造影(DSA)、动脉化疗栓塞(TACE)。
2.操作过程:采用“Sledinger”方法,“无菌、规范”操作。 “经皮、经股动脉”穿刺,由“数字减影血管造影机”引导,将导管引导至“腹腔干、肝总动脉”,“造影”检查,寻找肿瘤的“靶血管”,必要时作“肠系膜上动脉”造影检查,寻找“侧支和变异”的肿瘤“靶血管”。动脉造影的“特征性影像学图像”包括三期:动脉期、实质期、静脉期,DSA为“介入诊疗”的第一阶段。
(1)DSA 优点:1)发现直径 0.5—1.0 cm的微小病灶和肿瘤靶血管。2)肝癌DSA特征性影像学图像:肿瘤血管团;肿瘤染色;肝内动脉变形,表现为:增粗、移位,受侵动脉呈锯齿状、呈僵硬状态、肿瘤包绕动脉征象,有时可见动静脉瘘,池状、湖状造影充盈区等。3)DSA 对“微、小”肝癌的检出率,高于“目前业已开展的其它影像学检查”方法。4)DSA 是其他诊断手段,还不能完全替代的“重要影像学”检查方法,具有一定的诊断价值和学术地位。
(2)TACE为介入诊疗的第二阶段:1)采用微导管技术,“超选择”插管,直接对肿瘤靶血管,作节段性、亚节段性,甚至亚亚节段性“化疗和栓塞”治疗。2)目标:提高“杀灭癌细胞”效应,对“肝组织、肝脏周围脏器”损伤小,不良反应轻,并发症少。
肝癌—介入治疗模拟图
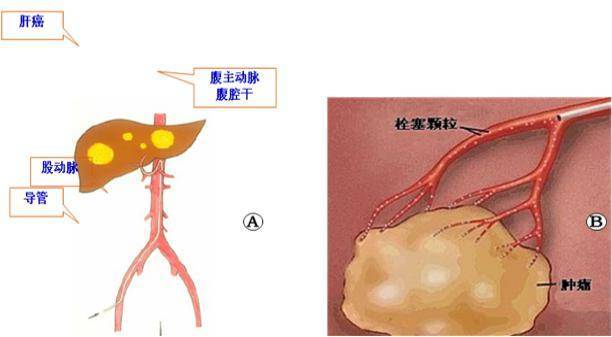
A:经皮、经股动脉穿刺,导管插入至腹腔干,然后进入肿瘤的供血血管。B:经导管释放化疗药物+碘油乳化剂,栓塞肝癌供血血管,必要时加入栓塞颗粒,增强栓塞效果。
肝癌—TACE疗效图
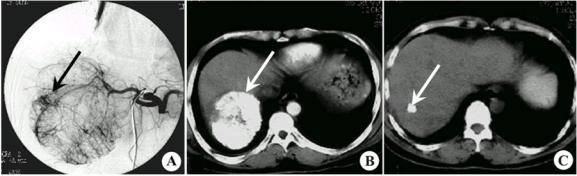
A:肝癌血管造影图。B:介入治疗,肿瘤内大量碘油存积。C:介入治疗后,肿瘤显著缩小。
医学界也已达成“共识”:肝动脉介入治疗是“不可手术切除肝癌患者”的首选治疗手段,在肝癌的综合治疗中,享有较高的学术地位。
五.内镜引导的逆行性胰胆管造影(ERCP)及鼻胆管、内支架植入
1.ERCP(endoscopic retrograde cholangiopancreatography) 即内镜下逆行胰胆管造影,是将十二指肠镜插至十二指肠降段,找到十二指肠乳头,经内镜活检孔道插入一造影导管,由乳头开口部,进入胆管或胰管内,注入造影剂,作X线胰胆管造影。
(1)适应症:
1)胆管结石、肿瘤、炎症、寄生虫或梗阻性黄疸且原因不明者;
2)胰腺肿瘤、外伤、慢性胰腺炎或复发性胰腺炎缓解期,以及胆源性胰腺炎须去除病因者;
3)胰十二指肠乳头或壶腹部炎症、肿瘤;
4)因胰胆病变需行内镜下治疗者。
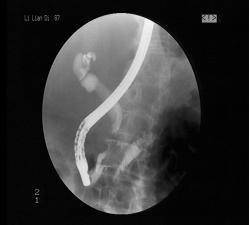
(2)胆道肿瘤造影特征性影像学表现(以胆总管癌为例):
 |
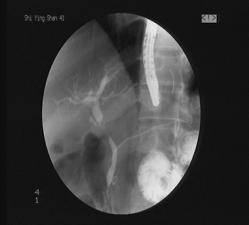 |
胆总管癌ERCP造影示胆道截断影
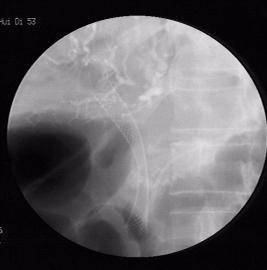
2.ERCP引导下的鼻胆管、内支架植入是非手术解除胆道梗性
黄疸的最佳微创介入治疗手段之一,避免了手术的创伤。
 |
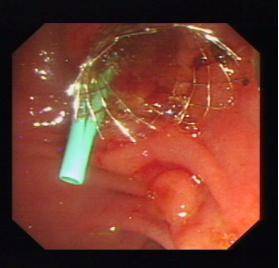 |
支架置入术后
六.消化道良性肿瘤、早期恶性肿瘤“内镜下”粘膜切除术(EMR)、粘膜下剥离术(ESD)
1. 内镜引导的下切除手术是目前创伤最小的手术方式,创伤程度显著小于常用的腔镜微创手术,且疗效显著。
2. 消化道肿瘤内镜下粘膜切除术(Endoscopic Mucosal Resection,EMR):对胃肠道息肉、平坦型腺瘤可以应用该技术行内镜下微创手术切除,达到治愈目的。
(1)适应症
1)消化道(胃、十二指肠及结直肠)单发或多发性息肉及各种良性肿瘤;
2)活检病理检查排除恶变者。
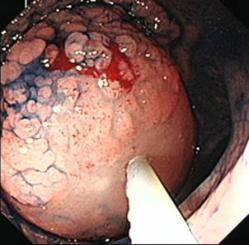
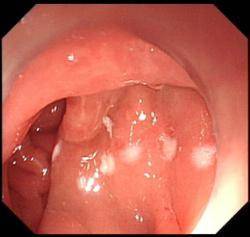
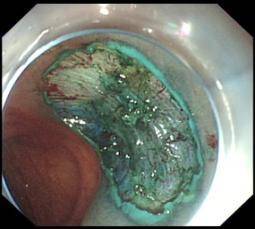
(2)结肠腺瘤EMR示意图(以结肠腺瘤EMR为例)
|
A:结肠腺瘤(染色图) |
B:注射针行黏膜下注射 |
|
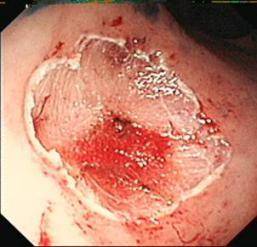
C: 切除后创面 |
D: 术后一月复查愈合良好 |
3.消化道肿瘤内镜黏膜下剥离术(Endoscopic Submucosal Dissection,ESD):对胃肠道癌前病变、早期癌及较大良性肿瘤,可以应用该技术行内镜下微创手术切除,达到治愈目的。
(1)适应症
1)消化道巨大平坦息肉及腺瘤,直径≥2cm;
2)食管、胃及结肠早期癌或癌前病变,局限于黏膜层(m)、粘膜下层或只有浅层粘膜下(sm1)侵犯,同时无局部淋巴结及远处转移者;
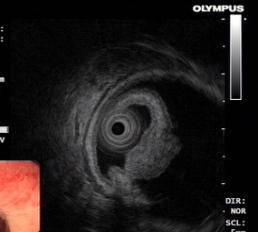
3)粘膜下肿瘤。超声内镜检查确定来源于黏膜肌层、黏膜下层及固有肌层的肿瘤。
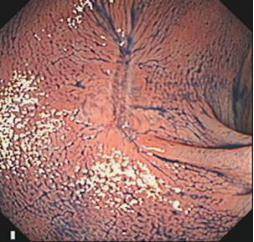
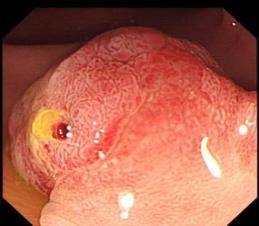
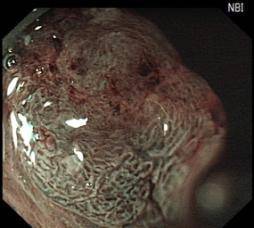
(2)ESD示意图(以结肠早癌ESD为例)
|
A: 降结肠巨大新生物(Ip型早癌) |
B: 放大染色pit ⅤA型,Sano ⅢA型 |
|
C: 超声内镜黏膜层的长蒂低回声肿物 |
D: 标记 |
|
E: 剥离后创面 |
F: 剥离后标本 |
七.综合治疗可选择的手段包括:
(1)微创消融治疗、介入诊疗等“多种微创介入治疗手段”的优化组合;
(2)外科干预微创介入治疗并发症、术中微创消融治疗、微创手术切除术等;
(3)放疗、化疗、生物治疗与分子靶向治疗、内分泌治疗、中医中药治疗、BSC等“其他多种治疗手段”均能够在综合治疗中加以合理应用。